

COLORANTI PER STOFFE
- origine e costituzione chimica dei coloranti
- classificazione in base all'impiego tintoriale
- storia della tintura naturale
- i principali cromogeni naturali
- i coloranti sintetici
- la scoperta di Pekin
- nuovi coloranti
- la scoperta di Griess
- il contributo di Kekulè
- la sintesi dell'alizarina
- la struttura dell'alizarina
- la sintesi di Caro dell'alizarina
- sintesi di Perkin dell'alizarina
- sintesi dell'indaco
- sintesi di Heumann
- introduzione di nuovi cromogeni
- coloranti allo zolfo, diretti, al tino e ftalocianinici
- coloranti per fibre moderne
- l'impiego dei coloranti in istologia
- colorazioni protettive
- sviluppi futuri
- produzione dei coloranti
COLORANTI ALIMENTARI
- le categorie degli additivi
- la storia dei coloranti
- coloranti naturali e sintetici
PARTE SPERIMENTALE
- sintesi del metilarancio
- utilizzo del metilarancio:
come indicatore acido, base
come colorante per stoffe
confronto tra colorante naturale e sintetico - sintesi dell'indaco
- confronto tra indaco sintetico e indaco naturale nella tintura della stoffa
- sintesi fluoresceina, cosina
- utilizzo della fluoresceina come colorante per stoffe

Origine e costituzione chimica dei coloranti
La maggior parte dei coloranti artificiali è messa in commercio in polvere, in cristalli, in pezzi, in pasta, con nomi che non sono indicativi della loro costituzione chimica ma che piuttosto si riferiscono al tono di colore, o sono di fantasia ( nomi di città, di persona, della ditta produttrice, ecc.). Inoltre spesso i vari nomi sono seguiti da più lettere aventi per lo più un preciso significato ( sono generalmente iniziali di parole tedesche ), e indicano la tonalità di un colore o la diversa gradazione di tinta; così se il nome di un colorante, per esempio rosso, è seguito da B o G significa che il suo tono tende al blu o al giallo; cosi un violetto metile seguito da R, 3R, 4R o B, 2B, 3B, ecc. indica colori volgenti al rosso o al blu con tonalità crescente ( il numero indica che il tono volge sempre più al colore indicato dalla lettera che lo segue ). A volte le lettere indicano certe proprietà della sostanza, così, ad esempio, L indica per lo più un colore solubile, S uno solfonatoo ecc. In base all'origine i coloranti possono suddividersi in inorganici ( minerali e artificiali ) e organici ( naturali e sintetici ). Alcuni coloranti inorganici minerali dotati di colore proprio hanno trovato, o trovano ancora, impiego: per esempio il cinabro ( rosso ), il biossido di titanio ( bianco ), l'oro musivo ( giallo ), l'azzurrite ( azzurro ), la terra d'ombra ( bruno ),ecc. Molti sono i coloranti inorganici artificiali, preparati per precipitazione di sali solubili: bianco di bario ( o solfato di bario ), litopone, solfuro di cadmio, azzurro di Berlino, verde di Guignet, ecc. Si può ricordare anche il "cachi" minerale ( o inorganico) largamente usato per tingere stoffe militari, costituito da una sola soluzione di acetato ferroso e di cromo; il tessuto viene prima bagnato in tale soluzione, asciugato a caldo, poi immerso in una soluzione di soda e, dopo lavaggio, di nuovo essiccato. Fra i coloranti organici quelli sintetici sono più numerosi e importanti di quelli naturali. Questi ultimi possono provenire dal regno animale o vegetale. Pochi sono i coloranti di origine animale che hanno trovato impiego pratico ( acido carminico della cocciniglia, bibromo indaco della porpora di Tiro ); più numerosi quelli di origine vegetale che hanno avuto importanza tecnico / commerciale (indaco, brasilina, acido ruberitrico, ecc.), alcuni dei quali resistono ancor oggi, di fronte alla numerosa schiera dei coloranti sintetici ( per esempio gli estratti di campeggio ). In relazione alla costituzione chimica, la distinzione dei coloranti si basa sul gruppo cromoforo principale presente e si distinguono così le varie classi di coloranti, indipendentemente dalle loro caratteristiche tintoriali. Secondo questo criterio di classificazione le principali classi sono le seguenti: nitroso colorante, nitro colorante, azo colorante ( mono / e poli / azo coloranti ), coloranti stilbenici, difenilmetano, coloranti tonimminici, metinici, polimetinici, chinolinici, trifenilmetano, coloranti xantenici, acridinici, tiazolici, indammine, coloranti indofenolici, azinici ( ossiazinici e tiazinici ), allo zolfo, lattonici, ammino / che tonici, idrossichetonici, o chetonici, antrachinonici, indigoidi, e tioindigoidi, ftalocimine. Secindo la destinazione, si distinguono: coloranti per fibre tessili ( che si suddividono a seconda della natura delle fibre ); coloranti per materie plastiche, per oli e grassi, per carta, per prodotti alimentari, per prodotti fotografici, per pelli, per cosmetici, per inchiostri, ecc.Classificazione in base all'impiego tintoriale
Il sistema più razionale di classificazione dei coloranti è quello basato sull'impiego tintoriale, cioè sui sistemi industriali di applicazione dei coloranti stessi: si distinguono così i seguenti tipi.Coloranti Acidi( o anionici ): possiedono auxocromi di tipo acido ( carbossile,ecc. ); sono capaci di tingere la lana e la seta ( non il cotone ) in bagno acido per l'affinità da essi presentata per i gruppi basici delle proteine animali e vegetali; si dividono in: semplici, al mordente e premetallizzati. Vi appartengono molti azoderivati, derivati solforici del frefenilmetano ( per esempio fucsina acida, violetto acido, eosina, ecc.), nitroso e nitro coloranti ( acido picrico, giallo naftolo, ecc.).
Coloranti azoici a sviluppo ( o anche sintetici su fibra): costituiti da coloranti azoici insolubili che si fanno formare ( o sviluppare ) direttamente sul supporto; derivano da naftoli, da benzotiazolo, ecc. La tintura si puo effettuare facendo seguire, al bagno del supporto nella soluzione alcalina ( per esempio slz di naftolo ), un successivo bagno nella soluzione di un diazocomposto; oppure nel modo inverso, diazotando sul supporto ( un derivato del benzotiazolo ) e copulando successivamente il prodotto. Si dicono anche coloranti al ghiaccio perché le operazioni vengono eseguite a bassa temperatura per impedire la decomposizione del componente azoico.
Coloranti basici: possiedono auxocromi di tipo basico ( gruppo amminico, sostituito o no ) e sono capaci di tingere lana e seta direttamente ( per esempio aurammina, fucsina, rodamina, blu di metilene ) o anche a cotone e seta artificiale in presenza di mordente ( tannino, sali d'antimonio ).
Coloranti a mordente: caratterizzati dalla presenza come auxocromo dell'ossidrile fenolico, rispetto al quale è presente in posizione orto o un altro gruppo –OH, o un azogruppo, o un carbossile,ecc.; hanno carattere debolmente acido a quindi non presentano sufficiente affinità con seta, lana, cotone, ecc., che non riescono a tingere in bagno acido, basico o neutro; però in presenza di un mordente ( sale metallico ) formano sul supporto un complesso mordente − colorante, insolubile; si suddividono in coloranti fenolici semplici ( alizarina, verde solido ), in coloranti fenolici basici ( gallocianina ) e acidi ( verde naftolo, ossichinonisolfonati, ecc.).
Coloranti di ossidazione: sono coloranti prodotti su fibra per ossidazione, in condizioni controllate, di anilina, p − fenilendiamina, ecc.
Coloranti pigmentari: costituiti da pigmenti organici, usati per la stampa dei tessuti, per la colorazione di fibre tessili artificiali di materie plastiche per la preparazione di inchiostri ecc. Sono insolubili in acqua o insolubilizzati sottoforma di lacche.
Coloranti reattivi: sono coloranti azoici, antrachinonici, ftalocianine, ecc., contenenti uno o più atomi o radicali capaci di reagire con i gruppi funzionali caratteristici di alcuni supporti ( − OH, − NH2, ecc. ) formando composti stabili: appartengono a questa classe i cloro − benzo − tiazoli, le clorodiazine. Si usano per cotone ( in bagna alcalino ), per lana, per fibre poliammidiche ( nailon, ecc.);fra coloranti e fibre si forma un legame covalente alla cui stabilità si deve la particolare solidità dei coloranti di questo tipo.
Coloranti sostantivi per cotone: costituiti da derivati solforici di composti azoici( o eteroclici) capaci, sotto forma di sali sodici,di tingere il cotone non mordenzato. A seconda della loro si distinguono in coloranti sostantivi derivati dalla benzidina ( o mologhi ),da varie diammine, dalla triazina, ecc.
Coloranti al tino: composti insolubili del gruppo dell'indaco, dell'antrachinone ( indantreni ), che per potersi fissare sul supporto devono essere prima solubilizzati per riduzione in ambente alcalino ( idrosolfito, ecc.); il prodotto che così si ottiene è solubile, incolore ( leucoderivato ) e capace di fissarsi sul supporto. Su di questo, esposto in ambiente ossidante ( per esempio l'aria ) si ripristina il colorante insolubile, che risulta così saldamente fissato. Si comprendono in questa classe anche esteri solfonicii dei leucoderivati ( per lana, seta, cotone, ecc.), solubili, che applicati su supporto vengono pio facilmente idrolizzati a leucoderivati che si ossidano all'aria ( sul supporto ).
Coloranti allo zolfo: Coloranti ottenuti riscaldando con zolfo composti organici di diversa nutra. Si possono considerare sia come coloranti diretti sia come coloranti al tino, perché, insolubili si fissano sul supporto solo dopo riduzione in bagno di solfuri alcalini e il colorante si sviluppa per ossidazione all'aria fissandosi stabilmente al supporto.
...Fin dai tempi preistorici l'uomo è rimasto affascinato dal Colore...

Storia della tintura naturale
I primi segni di questa attività risalgono all'incirca all'epoca neolitica quando l'uomo da nomade è passato a una vita stanziale. Ogni popolo ha iniziato a tingere i filati che aveva a disposizione, con prodotti naturali per la maggior parte di origine vegetale, piante, radici, licheni, ma anche insetti e molluschi che poteva trovare nelle zone in cui viveva. Gli Egiziani ad esempio tingevano soprattutto il lino, che cresceva molto rigoglioso , con piante come l'henné o il cartamo ( per il giallo e il rosso ), l'azzurro invece era estratto da alcune specie di indigofera o di isatis tinctoria. Il rosso proveniente dall'Egitto è stato per secoli il più bello del mondo. Gli Assiro−babilonesi tingevano essenzialmente la lana in fiocchi che poi miscelavano durante la filatura dando origine a stupendi tessuti. I Fenici, i quali sembra siano stati i primi ad utilizzare la porpora o comunque i primi a commercializzarla, ricavavano il colore da tipi di gasteropodi (Murex) i quali possiedono una vescichetta nella quale è contenuto un liquido giallo che al contatto con l'aria si trasforma in rosso. Gli indiani iniziarono a tingere i loro tessuti anche con tecniche molto particolari tipo il "tye and dye", (lega e tingi) in modo che il filato rimanesse, nei punti in cui non era legato, non tinto, dando origine a particolari motivi. A questo popolo si deve infine la scoperta della tintura con l'indaco, ancora oggi sono famosi gli azzurri dei cotoni Indiani. Nell'estremo oriente, dove l'utilizzo della seta risale al 300 A.C., i coloranti usati erano il cartamo per il giallo e il rosso, il mirtillo per il blu e il lilla e più tardi anche l'indaco, mentre i Giapponesi si specializzarono a tingere le loro sete con le alghe, anche se purtroppo conosciamo poco i loro metodi di tintura in quanto venivano tenuti segreti come pure la coltivazione del baco da seta. I Maya, Aztechi e Incas tingevano le loro lane a noi allora sconosciute come l'alpaca e la vicugna nei colori rosso di cocciniglia (un insetto), i marroni ottenti dalle radici e i gialli dal legno. Da questo periodo sino alla fine del 1800 grazie agli scambi commerciali con l'oriente e con le Americhe la tintura naturale ebbe notevole sviluppo e perfezionamento. Nacquero cosi scuole dove si insegnava l'arte del tingere le fibre e intorno al 1600/1700 furono scritti diversi manuali di tintura naturale.I principali cromogeni naturali
Numericamente i coloranti gialli comprendono la maggior parte dei coloranti naturali ma hanno una minore resa tintoriale dei rossi, dei blu e dei neri, e hanno basse proprietà di solidità, specialmente alla luce.I gialli naturali sono basati principalmente su cromogeni (flavoni, calconi, polieni) che sono molto instabili e sono stati completamente soppiantati da coloranti gialli sintetici. Tuttavia i cromogeni antrachinonici e indigoidi trovati nei coloranti naturali rossi e blu, sono alla base di molti dei moderni coloranti sintetici.
...Qualche formula di struttura...
Per i coloranti gialli
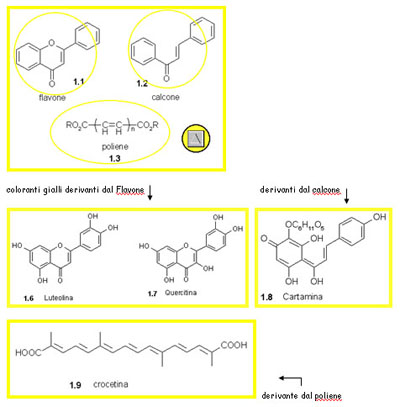
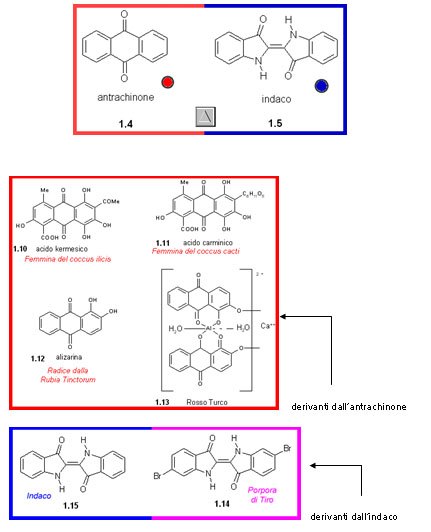
Per i coloranti rossi e blu...
I Coloranti Sintetici
...Un po di storia...Fino al 1800 poco era noto della Chimica Organica, perché potesse definirsi scienza.
- Lavoisier nel 1785 aveva trovato il metodo per bruciare una sostanza organica e analizzarne i vapori che si sviluppavano.
- Berzelius nel 1807 aveva descritto i composti organici come appartenenti alla materia vivente.
- Faraday nel 1824 aveva scoperto il benzene.
- Wohler nel 1828 aveva sintetizzato l'urea dimostrando che anche i composti organici obbedivano alle stesse leggi chimiche dei composti inorganici senza alcun intervento di Forza Vitale.
- Hofmann fin dal 1845, focalizzò l'attenzione dei chimici organici sul benzene e su altri composti ottenibili per distillazione del carbon fossile.
- Fra il 1800 e il 1845 i chimici svilupparono diversi metodi di analisi che permisero di conoscere la composizione elementare di qualunque sostanza organica ma nonostante questo la struttura di queste sostanze rimaneva sconosciuta.
La scoperta di Perkin
Fu Perkin, un allievo di Hofmann, che con la scoperta della Malveina nel 1856 diede origine alla "rivoluzione dei coloranti". Tuttavia la sua intenzione non era quella di preparare un colorante bensì quella di sintetizzare il chinino, un farmaco antimalarico. Considerando l'equazione stechiometrica pensò di poter ottenere il chinino per ossidazione della alliltoluidina con bicromato potassico in acido solforico.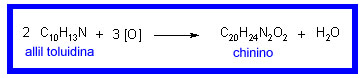
Ma ottenne una polvere bruna che certamente non conteneva il chinino. Trattandola a caldo con etanolo si otteneva una soluzione porpora che per raffreddamento lasciava depositare cristalli porpora.
...E cosi diventa imprenditore...
Perkin comprese che questo nuovo composto, che chiamò Malveina poteva servire come colorante e ne spedì un campione a una tintoria. Il rapporto fu estremamente entusiasta e risultò che per l'applicazione su seta nessuno dei coloranti naturali poteva competere per solidità al lavaggio e alla luce col nuovo colorante. Una volta stabilita l'utilità della Malveina come colorante, Perkin ne studiò a fondo la reazione scoprendo presto il corretto cammino di reazione e si mise a produrla su larga scala. Diventato così imprenditore, si rese conto che i problemi da superare erano enormi perché doveva anche produrre in grande scala sia l'anilina che la toluidina a partire dal benzene e dal toluene.
Nuovi coloranti
Nel 1859 Verguin scoprì il Magenta, per ossidazione dell'anilina con cloruro stannico dando così origine alla classe dei coloranti del trifenilmetano. Hofmann metilò i gruppi amminici del Magenta ottenendo una miscela di coloranti violetti, chiamati Violetti di Hofmann. I gruppi amminici non sostituiti possono essere rimpiazzati da gruppi fenilici. Girand e De Laire riscaldando il Magenta con anilina pura, ottennero il Blu di Rosanilina. Ma l'introduzione dei gruppi fenilici idrofobici, provocò l'abbassamento della solubilità in acqua rendendolo quasi inutilizzabile. Nicholson scoprì però che trattando il colorante con acido solforico concentrato la solubilità in acqua aumentava notevolmente.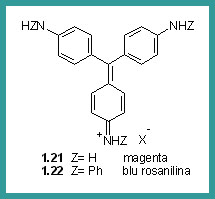
La scoperta di Griess
Un'altra importante classe di coloranti scoperta nel 1863 fu quella dei Neri di Anilina. Essi venivano prodotti direttamente sulla fibra per ossidazione dell'anilina. Il colorante appena formato polimerizzava all'interno della fibra conferendo straordinaria solidità al lavaggio. I neri di anilina sono ancora oggi usati per il cotone. È nello stesso periodo che Peter Griess scoprì la reazione di diazotazione. Questa reazione è la più importante nel campo dei coloranti, e i coloranti azoici da soli rappresentano il 50% della produzione dei coloranti nel mondo. Il primo colorante azoico di successo fu appunto il Bruno di Bismarck. Trattando un'ammina aromatica con un agente nitrosante come l'acido nitroso si ottiene un sale instabile che reagendo con ammine o fenoli aromatici, in opportune condizioni produceva sostanze intensamente colorate.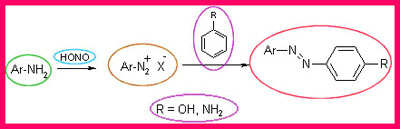
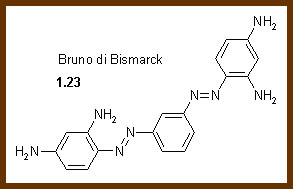
Il primo colorante azoico di successo fu il Bruno di Bismarck (1.23) che può essere preparato per doppia diazotazione della m−fenilendiammina per produrre il sale di bis diazonio e successivamente copulato con la stessa diammina per dare un colorante bis azoico.
Il contributo di Kekulè
Nel 1850 la formula empirica di un composto organico poteva facilmente essere stabilita con l'analisi elementare, ma la struttura di queste molecole restava un problema insolubile per i chimici dell'epoca. Fu negli anni 1857/58 che Kekulè andò pubblicando tutta una serie di lavori sulla teoria della valenza nei composti del carbonio. In questi lavori descrisse la tetravalenza del carbonio. Affermò inoltre che la gran varietà dei composti organici fosse dovuta alla capacità del carbonio di formare legami singoli e multipli con se stesso e con altri elementi. La soluzione della struttura del benzene (1865) ebbe un enorme impatto sia nella chimica organica sia nell'industria coloristica.La sintesi dell'alizarina
Nel 1868, dopo soli tre anni della scoperta della struttura del benzene, fu scoperta da Graebe e Liebermann la struttura dell'Alizarina ed eseguita la sintesi per bromurazione dell'antrachinone e successiva idrolisi. La strada proposta da Graebe e Liebermann non era però commercialmente praticabile e furono Caro e Perkin, che lavorando indipendentemente scoprirono una via più facile.La chimica coloristica aveva finalmente trovato la strada attraverso cui l'Alizarina potesse essere ottenuta più economicamente e più pura che non il prodotto naturale. In pochi anni il prodotto sintetico soppiantò completamente il prodotto naturale e centinaia di ettari che venivano utilizzati per la coltivazione della Robbia Tinctoria furono convertiti ad altre coltivazioni.
La struttura dell'alizarina
Un importante esperimento aveva permesso di determinare lo scheletro dell'alizarina (1.24): distillando l'Alizarina naturale estratta dalla Robbia Tinctoria, in presenza di polvere di zinco si otteneva l'antracene (1.25), composto già noto.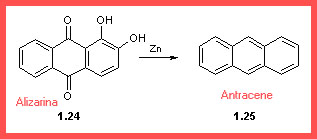
La sintesi di Caro dell'alizarina
La BASF in cui Caro lavorava aveva accumulato una gran quantità di antrachinone di cui non sapeva cosa fare.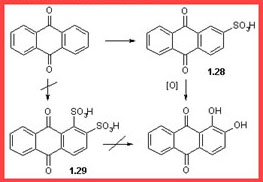
Caro la miscelò con acido solforico e acido ossalico e riscaldò la miscela nella speranza di ottenere un nuovo utile colorante.
Questa via sebbene più praticabile di quella della dibromurazione dell'antrachinone, non era la via più economica.
Infatti questa via comportava una disolfonazione (1.29) ad alta temperatura.
Attualmente l'Alizarina viene prodotta dall'acido monosolfonico (1.28) a più bassa temperatura piuttosto che dal derivato disolfonico, e richiede uno stadio di ossidazione fornito dall'ossigeno dell'aria.
Sintesi di Perkin dell'Alizarina
Approssimativamente nello stesso tempo Perkin scoprì la stessa sintesi dell'alizarina per solfonazione dell'antrachinone, ma fu battuto sul tempo da Caro nella registrazione del brevetto. Non si perse d'animo e scoprì presto una terza strada ancora migliore.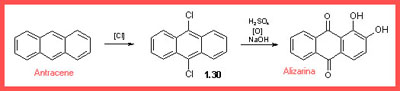
Per clorurazione dell'antracene, che era un diffuso prodotto dalla distillazione del carbone, si otteneva facilmente il 9,10 dicloro−antracene, che solfonato, ossidato e fuso con sodio idrossido dava l'Alizarina.
La sintesi dell'Indaco
L'enorme successo ottenuto con la sintesi dell'Alizarina spinse i chimici a provarci pure con un altro importantissimo colorante naturale: l'Indaco. Il più attivo fu von Bayer, che nel 1869 ne pubblicò la corretta struttura, e 11 anni dopo (1880) la sintesi a partire dall'acido o − nitrocinnammico. La prima sintesi industriale fu però quella di K. Heumann, con il contributo finanziario dalla BASF. Molti dei reagenti usati, come l'acido cloroacetico, non erano generalmente disponibili per cui si dovettero fabbricare apposta per questo processo. Il processo inoltre lavorava alla massima efficienza per rendere il prodotto più economico dell'Indaco naturale. Perciò i sottoprodotti vennero utilizzati per quanto possibile; per esempio l'anidride solforosa generata dall'ossidazione del naftalene, veniva riconvertita in acido solforico e quindi riciclata.Era noto che per distillazione dell'Indaco si otteneva l'anilina. Inoltre per riduzione dell'Indaco si otteneva l'indolo (1.31). Questi risultati e altre informazioni disponibili permisero a von Bayer di assegnare la corretta struttura per l'Indaco (1869).
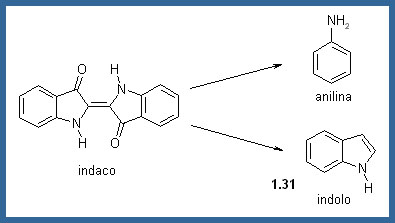
Sintesi dell'indaco di von Bayer, ma senza gran successo industriale
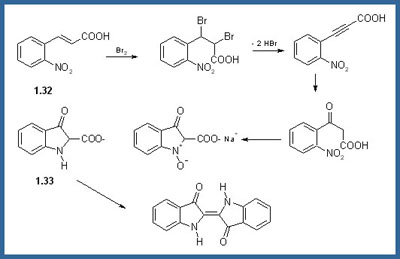
Sintesi di Heumann
L'acido antranilico veniva convertito in indossile (1.37) in due stadi: 1) per reazione con acido cloroacetico e 2) con una ciclizzazione di Dieckmann del diacido intermedio. Una volta formato, l'indossile dimerizzava per ossidazione atmosferica per formare il prodotto desiderato, l'Indaco. Sì, ma bisognava sintetizzare prima l'acido antranilico...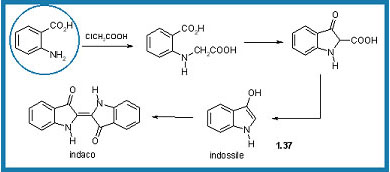
Introduzione di nuovi cromogeni
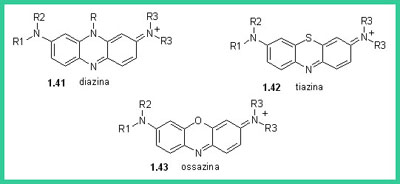
Mentre si sviluppavano i processi di sintesi di questi due importanti coloranti naturali, venivano sintetizzati nuovi coloranti non esistenti in natura. Venivano scoperte nuove classi di coloranti come gli xanteni, le tiazine, i coloranti allo zolfo. Il primo colorante xantenico venne ottenuto da Bayer condensando il resorcinolo (1.38) con anidride ftalica per dare la Fluorescina (1.39)che poi fu bromurata da Caro per dare l'Eosina (1.40). Molti coloranti strutturalmente correlati con gli xanteni furono sintetizzati in questo periodo come le diazine (1.41), le tiazine (1.42, Blu di metilene) e le ossazine (1.43, Basic Blue 3).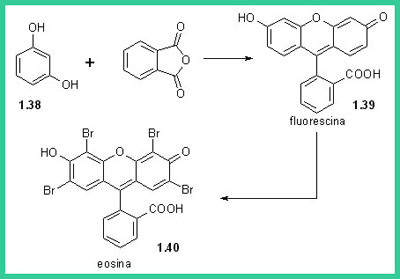
Coloranti allo zolfo, diretti, al tino e ftalocianinici
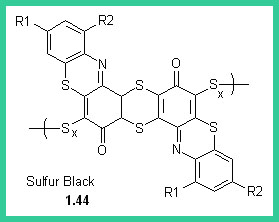
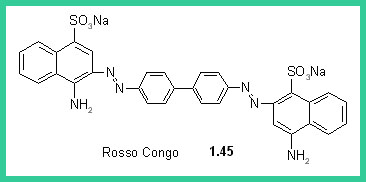
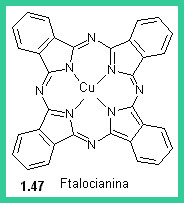
Nel 1873 Croissant e Betonniere scoprirono il primo colorante allo zolfo (1.44). Questi coloranti hanno una struttura complessa e vengono formati direttamente sulla fibra. Il Rosso Congo (1.45) un colorante azoico utilizzato ancora oggi come indicatore, fu il primo colorante diretto, cioè che tingeva la cellulosa da un bagno neutro, in presenza di solfato sodico. Agli inizi del XX secolo fu prodotto l'Indantrone (1.46), che aveva una solidità superiore a quella di qualunque altro colorante precedente e aprì la strada ai coloranti al tino. Nel 1930 furono commercializzati i coloranti ftalocianinici (1.47).I coloranti all Zolfo si preparano per riscaldamento di zolfo, ammine fenoli e amminofenoli. I coloranti così formati non sono solubili in acqua, ma diventano solubili per riduzione del bagno di tintura con formazione del leucoderivato che impregna la fibra. L'ossidazione atmosferica rigenera il colorante che presenta eccezionale stabilità al lavaggio.
Coloranti per fibre moderne
Ma la maggiore sfida per i produttori di coloranti venne con l'introduzione delle tre principali fibre sintetiche, il nylon, il poliestere e il poliacrilonitrile. Si scoprì che coloranti di basso peso molecolare e bassa solubilità in acqua,i Coloranti Dispersi, in presenza di opportuni coadiuvanti potevano tingere con toni brillanti queste fibre. Un'altra importante scoperta fu fatta nel 1954 da Ratte e Stephan dell I.C.I. con la scoperta di una nuova classe di coloranti contenenti il gruppo diclorotriazinico (1.48) e capaci di reagire con legame covalente con la cellulosa raggiungendo quindi elevatissime solidità al lavaggio.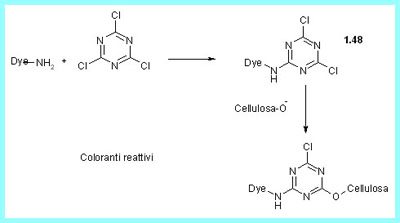
...Altri utilizzi dei coloranti...
L'impiego dei coloranti in istologia
Le numerosissime sostanze coloranti impiegate in istologia hanno lo scopo di colorare le varie parti della cellula e le sostanze intercellulari, aumentandone il contrasto e favorendone il riconoscimento. Alcuni dei coloranti più comuni sono i seguenti: ematossina ed eosina, ematossina ferrica, blu di metilene, blu di toluoidina, miscela Mallory − Azan, orceina, fucsina acida e basica, Sudan nero e Sudan rosso. Molte sostanze o miscele coloranti colorano in maniera più o meno elettiva i vari componenti della cellula o dei tessuti. Alcuni metodi di colorazione producono una colorazione elettiva di sostanze chimiche specifiche presenti nelle cellule o nel tessuto, permettendo di dimostrare la loro presenza e di localizzare in zone o organuli determinati delle cellule o del tessuto. Per esempio, il metodo di Feulgen colora in maniera elettiva in rosso violetto l'acido desossiribonucleico; il test di Brachet l'acido ribonucleico, il metodo acidoperiodico − Schiff i polisaccaridi. Alcune reazioni di colorazione sono basate su complessi fenomeni di adsorbimento o di precipitazione del colorante sulle strutture istologiche ( per esempio, i cosiddetti metodi di impregnazione metallica: oro, argento, platino), mentre altre sono dovute a vere interazioni chimiche tra i costituenti cellulari e il colorante ( per esempio , la reazione di Feulgen ).Colorazioni protettive
Gli animali Hanno Molti modi per Proteggersi dai loro nemici. Possono, ad esempio, difendersi combattendo, oppure abitare in posti nei quali difficilmente i loro nemici possono raggiungerli. Un altro mezzo di difesa è quello della colorazione protettiva. Gli animali che sono provvisti di colorazioni protettive sono difficilmente individuabili nel loro ambiente naturale. Alcuni serpenti ed alcuni insetti, che abitualmente vivono in mezzo all'erba, sono verdi. I pesci tropicali, dai colori così smaglianti a molto appariscenti in un acquario difficilmente posso essere visti fra i coralli e le piante acquatiche. Alcuni piccoli pesci sono così trasparenti che si rendono visibili solo quando si muovono. Alcuni animali che vivono in luoghi dove, col mutare delle stagioni, muta anche il colore dell'ambiente, posso cambiare persino il colore del loro corpo. Per esempio, la lepre alpina, la pernice bianca e gli ermellini durante l'inverno perdono il loro manto bruno e ne acquistano uno bianco. Quando un animale si trova nell'ombra, sembra più scoro di quanto non sia in realtà. Alcuni pesci, insetti e uccelli, per esempio, hanno la regione ventrale più chiara della regione dorsale, ma mentre il dorso è esposto alla luce il ventre resta in ombra, sicchè tutto appare dello stesso colore e senza rilievo, così da scomparire se il fondo è uguale. Questo tipo di colorazione è detta contrombra o, meglio ombra opposta. Un'altra colorazione protettiva è detta modellatura o dissimolazione dei contorni. Le strisce e le macchi rendono diffidi riconoscere la sagoma dell'animale. Questo stesso sistema, del resto, è usato dall'uomo durante le guerre nella tattica del mascheramento. La schiena macchiettata di un cerbiatto confonde questo animale fra le foglie di un bosco, il mimetismo è l'assunzione da parte di un animale di forme e colori che imitano quelli di altri animali protetti da armi o veleni, oppure che li fanno assomigliare agli oggetti circostanti. Ad esempio vi sono insetti innocui, che hanno aspetti e atteggiamenti simili a quelli di insetti pericolosi, come certe mosche e farfalle che sembrano vespe. Oltre al colore, anche la forma ha molta importanza in questo tipo di protezione. Per esempio, quell'insetto conosciuto con il nome di Stecchino ha proprio la stessa forma del ramoscello su cui abitualmente si posa. Certe cimici hanno l'aspetto di spine o di foglie. Alcune specie di farfalle sono di colore brillante quando volano; quando poi si posano e ripiegano le ali nascondendo il corpo e la parte vivacemente colorata delle ali, assumono l'aspetto e il colore delle foglie secche. Tuttavia non sono sempre le colorazioni protettive tendono a rendere poco visibile un animale. Alcuni, anzi, come la moffetta, essendo muniti di altre difese vengono evitati proprio perché sono proprio visti e riconosciuti. La loro colorazione è detta allarmante o, meglio, premonitrice e di questa proprietà gode anche il porcospino. Salvo rare eccezioni gli animali non possono ovviamente cambiare colore a loro volontà; tutta via questa caratteristica permette loro di sopravvivere e di moltiplicarsi.Sviluppi futuri
Negli ultimi decenni due nuovi problemi hanno condizionato la crescita dell'industria chimica e coloristica in particolare:- l'esponenziale crescita del costo dell'energia
- i vincoli tossicologici e ambientali
Produzione dei coloranti
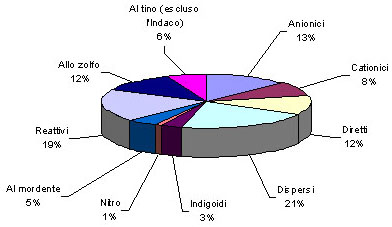
La produzione mondiale di coloranti è stimata in un milione di tonnellate. La metà è concentrata nei coloranti tessili, circa il 15% per la tintura di altri substrati (cuoio, carta). Il 25% della produzione è dedicato ai pigmenti organici, e il restante a usi particolari.

La maggior parte dei prodotti alimentari industriali contiene uno o più additivi naturali o artificiali. Si intende per additivo alimentare ogni sostanza diversa dall'alimento all'origine, che si trovi nell'alimento pronto per il consumo. Queste sostanze vengono aggiunte per ragioni tecniche o commerciali e non hanno alcun valore nutritivo. Vengono utilizzate tra l'altro allo scopo di rendere l'alimento più colorato, di mantenere l'aspetto e la consistenza originari fino al momento del consumo, di prolungare la durata di conservazione e, spesso, anche di mascherare l'assenza di alcuni ingredienti di valore o l'uso di materie prime di qualità scadente.
Le categorie degli Additivi
Gli additivi, a seconda della loro funzione, sono suddivisi in categorie e a ognuno è associato un codice valido in tutta Europa. Questo codice è formato da una "E" (significa Europa) e da un numero. È un codice stabilito dall'Unione europea per rendere uniforme in tutti i Paesi europei la designazione degli additivi e dei coloranti, che possono quindi essere indicati in etichetta anche con la sola sigla. Gli additivi volontari si classificano come:1 Additivi conservanti e antimicrobici
2 Antiossidanti, contro gli irrancidimenti e gli imbrunimenti
3 Addensanti, gelificanti, umettanti
4 Emulsionanti
5 Azione varia
6 Coloranti
Ogni additivo, in genere, ha un limite di impiego, il più delle volte nell'ordine di milligrammi per chilo o litro di prodotto alimentare nel quale viene messo, in altri casi secondo la formula "quanto basta". Tali dosi fanno riferimento alla DGA (dose giornaliera ammissibile) fissata da un apposito Comitato scientifico della CE: a scopo precauzionale, la DGA è, per l'uomo, la centesima parte di quella che è risultata innocua per l'animale da laboratorio sul quale è stata sperimentata per molti anni e con varie prove. Per ogni additivo, quindi, si pretende una sicurezza al cento per cento; inoltre è vietato usare additivi che non siano espressamente autorizzati e inclusi nella lista di quelli permessi (la cosiddetta "lista positiva") dopo ripetute prove scientifiche.
Le loro funzioni sono varie, ma hanno tutti degli scopi precisi che si possono così riassumere:
- mantenere il più possibile intatte le qualità nutrizionali;
- mantenere o migliorare le qualità organolettiche, cioè sapore, odore, colore e consistenza;
- evitare la formazione di sostanze o microrganismi tossici o indesiderati;
- consentire una maggiore durata nel tempo.
La storia dei coloranti
Era il 1856 quando un chimico inglese, Sir Willam Perkin, sintetizzò in laboratorio il primo colorante (mauvine). I primi coloranti di sintesi erano prodotti a partire dall'anilina, un derivato tossico del petrolio. Questi composti sintetici:- non impartivano odori particolari,
- erano stabili in diverse condizioni di lavorazione,
- costavano poco.
- coloranti di sintesi (o artificiali),
- coloranti naturali,
- coloranti nature−identical,
- caramello (caramel colours).
Come indica il nome, vengono utilizzati per attribuire agli alimenti un aspetto più colorato.
La dicitura "coloranti naturali" non significa che provengono dagli ingredienti dell'alimento, ma vuol dire semplicemente che si trovano in natura. Autorizzati in molti alimenti, i coloranti naturali e artificiali permettono troppo spesso di trarre in inganno il consumatore sulla vera natura degli ingredienti utilizzati (per esempio, colorante giallo per suggerire la presenza di uova). Inoltre, certi coloranti provocano allergie in alcune persone.
Alimenti nei quali non è consentito l'uso di coloranti sono acqua, zucchero, miele, latte, pane, pasta, carne, pesce, olio, caffè, cioccolato, torrone, aceto, succhi di frutta.
L'FBN (Food and Broad) stabilisce i motivi per cui i coloranti possono essere aggiunti agli alimenti:
- tecnologici o dalla conservazione
- assicurare uniformità di colore, correggendo eventuali variazioni naturali di intensità
- intensificare il colore qualora questi risulti più debole di quello che il consumatore associa a quell'alimento
- proteggere dai raggi del sole, durante la conservazione dell'alimento, l'aroma e le vitamine fotosensibili
- conferire un aspetto invitante a cibi che sarebbero altrimenti poco appetibili
- aiutare a conservare l'identità e le caratteristiche che permettono il riconoscimento dei prodotti
- fornire un'indicazione visiva della qualità
− naturali
Includono componenti dei prodotti alimentari ed altri elementi di origine naturale. Sono sopratutto sostanze di origine vegetale, ed in minor misura di origine animale.
Molte di queste sostanze vengono attualmente prodotte in laboratorio.
− sintetici
Presentano il vantaggio di essere più stabili e meno costosi dei coloranti naturali ma lasciano più dubbi sulla loro innocuità. Confrontando infatti le formule dei coloranti tuttora ammessi con quelli riconosciuti invece tossici e vietati, si notano somiglianze impressionanti che non possono lasciare indifferenti. I maggiori imputati sono i coloranti azoici caratterizzati dal gruppo cromoforo azo (ad es. E 110).
Possono essere impiegati solo negli alimenti indicati dalla legge e comunque entro le dosi massime d'impiego consentite.
Da E100 a E199 sono classificati i coloranti, a gruppi di decine: per esempio, fra E100 ed E109 è compresa la famiglia dei coloranti gialli, fra E110 ed E119 i coloranti arancioni, fra E120 ed E129 quelli rossi e così via.
I coloranti naturali con codice CEE da E 170 a E 180 sono coloranti inorganici e possono essere utilizzati esclusivamente per la colorazione della sola superficie esterna dell'alimento.
Coloranti inorganici
| Codice e colore | Denominazione | Nocività | DGA |
|---|---|---|---|
| E 170 bianco | Carbonato di calcio | - | non definita |
| E 171 bianco | Biossido di titanio | - | non definita |
| E 172 ruggine | Ossidi e idrossidi di ferro | - | non definita |
| E 173 alluminio | Alluminio | - | non definita |
| E 174 argento | Argento | - | non definita |
| E 175 oro | Oro | - | non definita |
| E 180 rosso | Litolrubina BK | - | non definita |
Questa classe di coloranti non ha nessun effetto nocivo noto.
I coloranti naturali con codice CEE da E 100 a E 163 sono coloranti organici e possono essere utilizzati sia per la colorazione della massa dell'alimento, sia per la colorazione della sola superficie esterna.
Coloranti organici
| Codice e colore | Denominazione | Nocività | DGA |
|---|---|---|---|
| E 100 giallo | Curcumina | Sospetto | 0,1 mg/kg |
| E 101 giallo | Riboflavina | − | non definita |
| E 120 rosso | Cocciniglia | Rischi di allergie. Questo colorante è tradizionalmente ottenuto dall'estrazione dei corpi essiccati delle femmine di coccinella americana che contiene fino a 10% di acido | 2,5 mg/kg |
| E 140 verde | Complessi rameici delle clorofille | − | senza limite |
| E 141 verde | Clorofille e clorofilline | Sospetto se contiene impurità o residui di rame | 15 mg/kg |
| E 141 verde | Clorofille e clorofilline | Sospetto se contiene impurità o residui di rame | 15 mg/kg |
| E 153 nero | Carbone medicinale vegetale | Se prodotto con metodi non corretti sembra responsabile di alcune forme tumorali | non definita |
| E 160a sfumature diverse | Caroteni, Caroteni misti, beta−carotene | ||
| E 160b sfumature diverse | Annata, Bissina, Norbissina | ||
| E 160c sfumature diverse | Estratto di paprica, Capsantina, Capsorubina | ||
| E 160d sfumature diverse | Licopina | Nessuna nota | non definita |
| E 160e sfumature diverse | beta−apo−8' − carotenale (g30) | ||
| E 160f sfumature diverse | Estere etilico dell'acido beta−apo−8'− carotenico (C30) | ||
| E 161 sfumature diverse | Xantofille | ||
| E 161b sfumature diverse | Luteina | Nessuna nota | senza limiti |
| E 161g sfumature diverse | Cantaxantina | ||
| E 162 sfumature diverse | Rosso di barbabietola, Betanina | Nessuna nota | senza limiti |
| E 163 sfumature diverse | Antociani | Nessuna nota | senza limiti |
L'attenzione crescente da parte dei consumatori sulla sicurezza dei coloranti ha indotto un incremento del mercato di quelli naturali, fenomeno agevolato anche dai progressi nelle tecnologie di estrazione. Tuttavia i coloranti di sintesi continueranno ad essere usati anche in futuro per i loro costi inferiori e la maggiore stabilità. Attualmente l'UE ha autorizzato 43 coloranti come additivi: 17 sono artificiali, il resto sono derivati da materie prime naturali o sono nature−identical.
Metilarancio
Il metilarancio è una molecola organica di tipo sintetico, e può essere utilizzata sia come indicatore acido−base, sia come colorante per stoffe.Essa è composta da due gruppi benzilici polifunzionali uniti da un gruppo AZO (Ar−N=N−Ar).
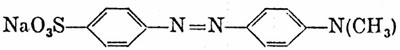
Sintesi del metilarancio
Reagenti utilizzati:- acido solfanilico (H2NC6H4SO3H)
- dimetilanilina (C6H5N(CH3)2)
- nitrito di sodio (NaNO2)
- acido cloridrico (HCl)
L'unico metodo di purificazione utilizzato in questa sintesi è stato la cristallizzazione. Infatti si è sempre operato in un'unica soluzione acquosa. Inoltre il metilarancio è un sale solubile a caldo in acqua ma insolubile a freddo in acqua, due caratteristiche ottime per un buon solvente di cristallizzazione.
Una buona solubilità in acqua a caldo gli viene data dal gruppo solforico, perché è l'unita parte di molecola che si salifica.
Metilarancio come indicatore
Il metilarancio può essere utilizzato come indicatore in quanto presenta un viraggio di colore intorno a pH 3,2 − 4,4. In ambiente acido (pH 3) esso si presenta con una colorazione rossa, e vira, attraverso una colorazione arancione, fino ad ottenere una colorazione gialla a pH superiore a 4.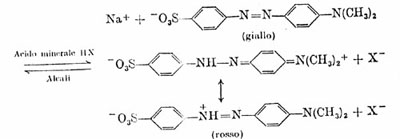
Metilarancio come colorante per stoffe
Il metilarancio è anche un ottimo colorante per stoffe, ma è necessario effettuare prima del bagno di colore un bagno di mordenzante, per far si che il colore resti attaccato alla stoffa.Esso è considerato un buon colorante per stoffe perché presenta una buona solidità, cioè ha una buona resistenza ai lavaggi, al sudore e alla luce.
La mordenzatura
La mordenzatura consiste nell'effettuare un bagno di mordente alla stoffa prima del bagno di colore. Il mordente può essere un sale di metallo quale Allume (solfato di alluminio e potassio), rame (solfato rameico), cromo (bicromato di potassio), stagno (cloruro stannoso), ma anche acido tannico. Esso si lega ai gruppi nitritici e ossidrilici della stoffa, formando poi dei ponti con il colorante (l'acido tannico invece funge da colla).
2° bagno ——> FeSO4 . 7H2O
3° bagno ——> SnCl2 . 2 H2O
4° bagno ——> NH4Al(SO4)2 . 12H2O
5° bagno ——> senza mordenzante
Tutti i bagni hanno una concentrazione 0,1M in mordente.
Come stoffa sono stati utilizzati seta e cotone, una fibra di origine animale e una di origine vegetale. Esse sono state lasciate nei bagni di mordenzante per circa 15−20 minuti. Inoltre ai bagni è stato aggiunto del cloruro di sodio (NaCl) per rendere la stoffa più lucente.

Si può notare che la stoffa, sia cotone che seta, immersa nel colore senza mordenzatura non presenta una buona colorazione.
Tutti i pezzi di seta mordenzati presentano una colorazione arancione molto intensa e lucente.
Il cotone presenta una colorazione media, che varia dall'arancione chiaro al rosa.
Robbia (Rubia tinctorum L. − Fam. Rubiaceae)
Etimologia della parola: il suo nome deriva dal latino ruber = rosso, con cui veniva identificata presso i Romani la radice di questa pianta utilizzata per tingere la lana.
Descrizione.
Pianta erbacea, perenne, flessibile ma tenace. Sul fusto presenta brevi aculei rivolti verso il basso, e le foglie sono opposte, caduche. I fiori, che fioriscono da aprile a giugno, sono raccolti in pannocchie. Il frutto é una bacca carnosa che a maturità diventa nera, lucida e sferica.

Origine, diffusione e cenni storici.
Specie Ovest e Centro−Asiatica, fu coltivata fino al secolo scorso. Essa è stata in passato largamente coltivata dall'uomo, sia nelle zone d'origine, Asia occidentale e Caucaso, sia in tutta Europa meridionale ed occidentale, fin dal tempo dei romani. Nei secoli successivi questa specie fornì una delle più importanti materie coloranti, il "rosso−turco". Erano state selezionate molte varietà, ma quella più pregiata era quella di origine italiana. La parte economicamente più importante della pianta è la radice, dalla quale si estrae la materia colorante rossa, l'"alizarina". Oggi le coltivazioni di Robbia sono limitate ad alcune località africane o asiatiche, per l'artigianato locale. Le poche importazioni che ancora si effettuano servono alla produzione di lacche e coloranti vegetali.
Estrazione dei pigmenti ed utilizzazione.
Le radici di robbia, utilizzate per l'estrazione dell'alizarina, venivano seccate al sole e poi macinate ottenendo una polvere che poteva essere conservata per diversi anni. La tintura di lana e seta veniva fatta procedere da una mordenzatura con allume di potassio, si procedeva poi ad immergere le fibre in un bagno tiepido contenente il 40% di polvere di robbia. Prove di tintura effettuate impiegando 30g di polvere secca su 100g di filato, hanno messo in evidenza che le radici di robbia sono in grado di fornire tinte di un bel colore intenso su lana, seta e cotone. Sono state inoltre evidenziate influenze genetiche nella resa in colore, nella tonalità e nel grado di brillantezza. É stata valutata la solidità alla luce del colore sui diversi tipi di filato sotto l'azione di una sorgente luminosa artificiale ed i risultati hanno dimostrato che la solidità alla luce aumenta passando dal cotone alla seta e alla lana.

Struttura chimica dei pigmenti.
L'alizarina, acido alizarico o deossiantrachinone, si trova nella radice fresca della robbia in forma di glucoside come acido ruberitrico, il quale per fermentazione o ebollizione con gli acidi e con gli alcali si scinde in un disaccaride (primaverosio) e alizarina. I dati di una recente sperimentazione hanno messo in evidenza che la quantità di alizarina totale presente nelle radici giovani è maggiore (8,2 mg/g di radice secca) rispetto a quella presente nelle radici raccolte dopo 15 e 30 mesi dall'impianto (6,8 e 7,1 mg/g rispettivamente). Man mano che la radice si accresce l'alizarina sembra accumularsi più in forma di glucoside, come acido ruberitrico, che come aglicone; passando infatti da radici di 5 e 30 mesi di età, il 31,5% e il 50,2% dell'alizarina totale rispettivamente è sottoforma di glucoside. Sono state osservate differenze nel contenuto di alizarina tra diversi genotipi analizzati al secondo anno di età (da 6,5 a 7,9 mg/g). l'alizarina sembra accumularsi preferenzialmente nella corteccia della radice. Oltre all'alizarina, nella radice di robbia, sono contenuti altri antrachinoni: rubiadina, purpurina, purpuroxantina, ecc.
Confronto tra la stoffa colorata col metilarancio e quella colorata con la Robbia:

I pezzi di stoffa utilizzati per queste foto sono di seta mordenzata con allume di potassio.
Un altro colorante naturale...
Reseda o Erba guada
(Reseda luteola L. e Reseda lutea L. − Famiglia Resedaceae)Etimologia della parola: il nome Reseda deriva dal latino resedo = calmo, attribuito a questa pianta da Plinio in relazione alle sue proprietà medicinali.

Descrizione.
R. luteola: pianta annuale, biennale o perenne, con fusto glabro, eretto, semplice o ramoso.
Origine, diffusione e cenni storici.
La R. luteola è una specie eurasiatica tipica dei paesi a clima temperato−caldo del bacino del Mediterraneo. Cresce bene in zone ruderalizzate da secche a mediamente secche, bordi di strade, ghiaioni calcarei, colonizzando spesso colture perenni, quali i vigneti. In Italia è presente allo stato spontaneo in tutto il territorio ad eccezione del Friuli e di gran parte della Pianura Padana.
La R. lutea è molto diffusa in Eurasia. Comune su tutto il territorio nazionale, colonizza facilmente luoghi incolti, ruderi, greti e massicciate. In terreni asciutti e friabili diviene spesso infestante nelle coltivazioni di erba medica e trifoglio. La conoscenza e l'utilizzo della Reseda sono noti all'uomo fin dall'antichità: fu Plinio, infatti che dette tale nome, riferendosi alle proprietà medicinali di queste piante utilizzate per la loro azione lenitrice nei casi di morsicature.
Estrazione dei pigmenti ed utilizzazione.


La R. luteola contiene in tutte le sue parti la luteolina, un principio colorante molto solido, di un bel giallo vivo. Per l'estrazione della luteolina viene effettuata la raccolta della painta intera durante la piena fioritura, alla quale può seguire l'essiccazione oppure l'utilizzazione del prodotto fresco. Il campo di applicazione è costituito essenzialmente dal settore tessile nel quale viene usata soprattutto per la tintura di lana e seta. La luteolina appartiene ai coloranti del tipo "a mordente". Prove recenti di tintura effettuate impiegando 30 g di polvere secca su 100 g di filato, hanno messo in evidenza come le foglie e le infiorescenze di R. luteola siano gli organi più ricchi di luteolina ed in grado di fornire tinte di un bel colore giallo intenso sia su lana, seta e cotone.
I soli fusti non si sono dimostrati in gradoni colorare alcuni tipo di filato. Sono state inoltre evidenziate differenze genetiche nella resa in colore, nella tonalità e nel grado di brillantezza. È stata valutata la solidità alla luce del colore sui diversi tipi di filato sotto l'azione di una sorgente luminosa artificiale. I risultati hanno dimostrato che la solidità alla luce diminuisce passando dal cotone alla seta e alla lana.
Struttura chimica dei pigmenti.
Il pigmento caratteristico della reseda è la luteolina, flavonoide contenuto in tutte le porzioni della pianta.

Sintesi dell'indaco
Reagenti utilizzati:- acido antranilico (o−H2NC6H5COOH)
- acido cloroacetico (ClCH2COOH)
- NaOH aq.
- O2
L'indaco è insolubile in acqua, a meno che non venga trattato con una tecnica che verrà spiegata successivamente.
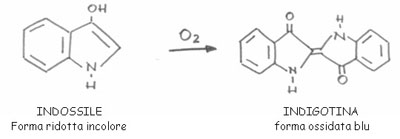
L'indaco, il colorante naturale più antico conosciuto.
L'indaco è il più antico colorante conosciuto, e già gli egiziani lo utilizzavano per tinteggiare i teli nei quali venivano avvolte le mummie. La particolarità di questo colorante è riscontrata nel fatto che esso possiede proprietà tintoriali estremamente diverse a seconda delle percentuali di impurità che la sua forma naturale inevitabile contiene. Questa sostanza viene classificata nella categoria dei coloranti al tino; la sua forma colorata, infatti, è insolubile in acqua e di conseguenza l'unico modo per poterla utilizzare è trasformarlo nella sua forma incolore, che è solubile in acqua. La soluzione giallognola che ne risulta è impiegata per impregnare la stoffa, la quale successivamente verrà esposta all'aria che ossiderà il colorante riportandolo alla sua forma blu.
Anticamente per tingere con l'indaco la polvere di colorante veniva sciolta in urina fermentata e vi si immergeva il filato che all'aria assumeva la forma colorata.
Attualmente, come abbiamo fatto anche noi, la stoffa è dapprima sottoposta a mordenzatura (descritta sopra), successivamente si procede alla preparazione del bagno di colore, il quale si ottiene aggiungendo NaOH, acqua bollente e idrosolfito di sodio alla soluzione eterogenea di polvere di indaco (sintetico o naturale) e acqua. Ne risulterà una soluzione giallognola la cui colorazione è dovuta alla forma ridotta dell'indaco. Immergiamo la stoffa nel bagno di colore lasciandola al suo interno per qualche minuto. Una volta estratto il filato (la cui colorazione tenderà al verde scuro) lo esponiamo all'azione ossidante dell'aria e dopo 15−20 minuti esso apparirà ai nostri occhi della tonalità desiderata. Eseguendo la tinteggiatura su seta e cotone possiamo notare che il colore "attacca" meglio al secondo tessuto. L'indaco risulta sicuramente il colorante per eccellenza più conosciuto in quanto è proprio con questo che si ottiene il colore del jeans.

Indaco (Indigofera tinctoria)

Etimologia della parola: indaco deriva probabilmente dall'india,maggiore produttrice di tale colorante.
L'indaco si può ricavare sia dall'Isatis Tinctoria (nome volgare: guado), pianta appartenente alla famiglia delle CRUCIFERE (per intenderci la stessa famiglia del cavolo) ed è indigena nelle regioni temperate dell'Europa del Nord, che dall'Indigofera tinctoria.
Il guado è una specie biennale con foglie astate e fiori gialli riuniti in racemi molto densi, i sepali sono gialli come i petali e i frutti sono delle silique pendule, ellittiche oppure lanceolate. La troviamo frequentemente lungo i bordi delle strade e in luoghi calpestasti. Fiorisce da maggio a settembre.
L'estratto colorato si può ricavare da numerosi vegetali, ma viene principalmente lo si ottiene dall'Indigofera tinctoria. Da 1 quintale di foglie si ottengono 1−2 kg di indaco puro, usato prevalentemente per colorare tessuti filati e per l'azzurratura della biancheria e per uso artistico. Attualmente entra nella composizione di alcuni preparati coloranti naturali per capelli.
Estrazione dei pigmenti e utilizzazione. Nella pratica in uso nei tempi passati le foglie del guado venivano fatte macerare in acqua a temperatura ambiente. Durante questa fermentazione si favoriva l'idrolisi dei precursori dell'indaco in indossale. Il liquido, che acquistava una colorazione giallo−verdastra, veniva agitato e rimescolato in modo da favorire l'ossidazione che faceva precipitare l'indossile sottoforma di fiocchi d'indaco blu o indigotina. L'indaco è un colorante molto solido e insolubile in acqua. Il suo impiego richiede l'applicazione del processo cosiddetto al tino, che permette in presenza di sostanze riducenti come l'idrosolfito di sodio, la formazione di leucoderivati solubili capaci di fissarsi alla fibra.
La struttura chimica dei pigmenti.
La formula dell'indaco classificato come natural blue 1 è:
ma nella pianta sono presenti due precursori: l'isatano B (indossil−5−cheto−D−gluconato) e l'indacano (indossil−β−D−glucopiranoside). L'indacano nelle foglie costituisce il 5−20% dell'isatano B, mentre nelle radici è presente il 97−99% e il restante è isatano B. Sia l'indacano che l'esatano B sono solubili in acqua.
Sintesi Fluoresceina

Reagenti utilizzati:
- anidride ftalica (C6H5)
- resorcina (o−C6H4(OH)2)
- zinco cloruro (ZnCl2)
- HCl
Se si preleva una piccola parte di soluzione subito dopo l'aggiunta di NaOH, e la si diluisce in un pallone da 500 ml, si ottiene una soluzione verde, che cambia tonalità da verde−rosso a verde−evidenziatore, a seconda della luce. Un'ulteriore diluizione della soluzione porta ad una colorazione gialla intensa: il colore della fluoresceina.
Sintesi Eosina
Reagenti utilizzati:- fluoresceina
- Br2
L'eosina si ottiene in forma solida, cristalli rossi con riflessi blu o in una polvere rosso−marrone. È molto solubile in acqua, meno in alcool e insolubile in etere. La soluzione acquosa presenta un intenso colore rosso−marrone, quella diluita (1:500) è gialla−rossa con una fluorescenza verde, mentre quella alcolica presenta solo una forte fluorescenza verde.
Essa viene utilizzata nei rossetti, negli smalti, per colorare la lana, la seta e la carta. Viene utilizzata anche negli inchiostri rossi.

Procedimento
Dalla sintesi precedente abbiamo ottenuto come prodotto la fluoresceina. Essa si pone in un pallone da 250 ml e la diluisco con etanolo al 95%. Si pongono 5 ml di Br2 in un imbuto gocciolatore e, una volta sistemato sopra al pallone, si aggiunge il bromo alla fluoresceina goccia a goccia, per 20 minuti. Si lasca riposare la soluzione per due ore, dopodiché si filtra a freddo l'eosina.
Essendo il bromo un composto mutageno, è necessario lavorare con le dovute precauzioni.
Conclusioni
Il lavoro che abbiamo svolto sui coloranti è stato molto interessante perché ci ha fatto scoprire un mondo della chimica nuovo. Anche se le metodiche che si svolgono sono sempre le stesse, la colorazione che si ottiene sulla stoffa mostra sempre delle sfumature diverse, che sono imprevedibili anche ad una mente estremamente razionale come quella del chimico!In questi anni, in Italia, si stanno studiando coloranti di tipo naturale; in particolare in zone come le Marche ci sono degli impianti sperimentali di guado, dal quale si ottiene l'indaco.
Anche nella nostra provincia di Modena una delle più importanti tintorie sta producendo capi di abbigliamento tinti con coloranti naturali.
FONTI
- www.milleunoalimenti.it
- www.antoniotombolini.com/trashfood
- www.altroconsumo.it
- www.sicurezzalimentare.it
- www.vegetariani.it
- Enciclopedia italiana del '900
- Lessico universale italiano
- Enciclopedia Garzanti